Çocuklarda Aşı Uygulamaları
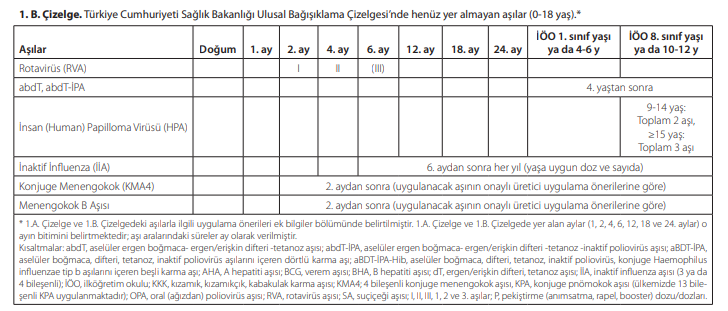
Türkiye’nin, Genişletilmiş Bağışıklama Programı (GBP) kapsamında yıllardır başarıyla uygulanan ve hızla güncellenen bir Çocukluk Dönemi Ulusal Aşı Çizelgesi (takvimi) vardır. Tablo-1 de 2020 yılında güncellenen Ulusal Bağışıklama Çizelgesi bulunmaktadır.
 Tablo-2’de takvimde bulunmayan aşılar ve uygulama takvimi bulunmaktadır. Yazımız da bu aşılardan bahsedilecektir
Tablo-2’de takvimde bulunmayan aşılar ve uygulama takvimi bulunmaktadır. Yazımız da bu aşılardan bahsedilecektir
Rotavirüs (RV) aşısı (RVA)
Ülkemizdeki çalışmalar, rotavirüsün, başka ülke verilerine benzer biçimde, ayaktan izlenen ve yatan akut ishalli çocuklarda önemli bir etken olduğunu göstermektedir. Rotavirüs aşısı, hastalık yapıcılık (patojenite) yönünden güçsüzleştirilmiş virüsler içeren canlı bir aşıdır, ağız yoluyla uygulanır.
Ülkemizde onaylı 2 rotavirüs aşısı ülkemizde de onaylıdır:
Zayıflatılmış Human Rotavirus Aşısı (Rotarix®)
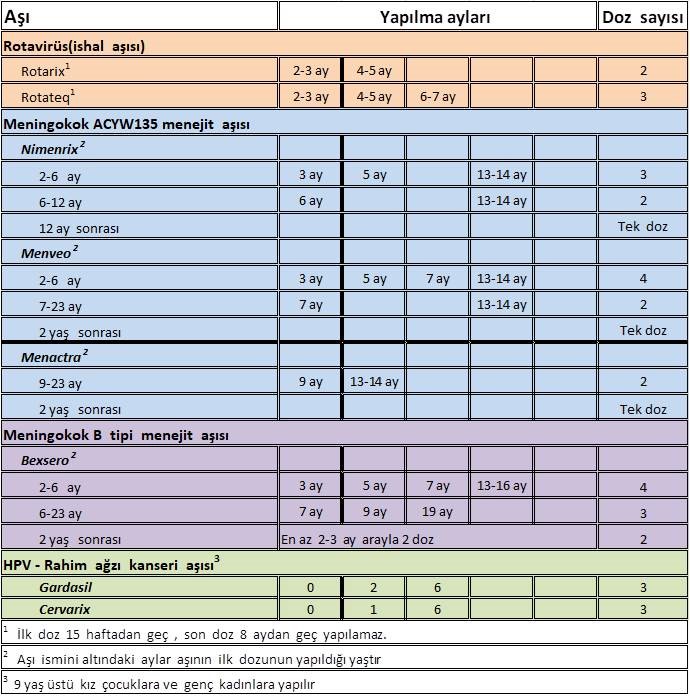
Rotarix®’in şiddetli rotavirus gastroenteritine ve hastane yatışına karşı koruyucu etkinliği %85, herhangi bir nedenle oluşan şiddetli gastroenterit ve hastane yatışına karşı etkinliği ise %40’tır. Bu çalışmalar Rotarix®‘in etkin, güvenilir ve iyi tolere edilen bir aşı olduğunu göstermiştir. Rotarix® En az 4 hafta (1 ay) arayla toplam 2 kez uygulanır; 2 ve 4. aylarda yapılması önerilir. ABD’de yine 6-15. hafta arasında uygulama başlatılmakta ve 8. aydan önce 2 doz tamamlanmaktadır.
Bovine-Human Reassortant Rotavirus Aşısı(RotaTeq®):
En az 4 hafta (1 ay) arayla toplam 3 kez uygulanır; 2, 4 ve 6. aylarda yapılması önerilir. İlk doz 6. haftadan itibaren uygulanabilir, ancak 15. haftadan önce de uygulanmış olmalıdır (maksimum 14 hafta 6 gün). Yanlışlıkla 15. hafta ve sonrasında ilk dozla aşılanmış infantlarda rutin aşılama programına devam edilmelidir. İlk dozun zamanlaması sonraki
dozların güvenirliğini etkilememektedir. Dozlar arasında minimum 4 hafta bulunmalıdır. Son doz 8. aydan önce tamamlanmış olmalıdır
RotaTeq® ile Aşılama sonrası, 68.038 kişi 2 yıl boyunca izlenmiş, aşının poliklinik başvurularını %86, acil servis başvurularını %94, hastaneye yatışı %96 oranında azalttığı saptanmıştır. Aşı herhangi bir etkene bağlı gastroenteritle ilgili hastane yatışlarını ise %59 oranında azaltmıştır
- Rotavirüs aşıları ülkemizde çocuklara uygulanan diğer aşılarla eş zamanlı olarak uygulanabilir.
- Aşılamanın farklı rotavirüs aşılarıyla tamamlanmasına ilişkin veri yoktur ve uygulanması önerilmez.
- Rotavirüs aşıları ağır birleşik (kombine) bağışıksal (immün) yetmezliği olanlara yapılmamalıdır.
Mevsimsel ölü (inaktif) influenza (grip) aşıları (İİA)
İnfluenza virüs enfeksiyonları özellikle küçük çocuklarda daha ağır seyretme ve daha ağır seyreden diğer solunum enfeksiyonlarına taban oluşturma eğilimindedir. İnfluenza enfeksiyonlarının her yıl, özellikle okul çağı çocuklarında salgınlar yaptığı, çocuklarda başlayan salgınların erişkinlere yayıldığı, eğitim günü, sağlık işgücü ve çalışan anne-babalar açısından iş günü yitimine yol açtığı bilinmelidir.
Mevsimsel influenza aşıları, aşılananları bütün grip enfeksiyonlarından koruyamaz. Bu nedenle, her yıl influenza salgın dönemi (mevsim) öncesinde, olasılıkla salgın yapacağı öngörülen influenza virüslerine karşı geliştirilen -genelde- farklı kapsamda bir influenza aşısı kullanılır. Konuda aileler bilgilendirilerek, influenza aşılamasının 6 aylıktan büyük bütün sağlıklı çocuklara uygulanmasına yönelik çabalar desteklenmelidir.
Ülkemizde farklı üreticilerin; 3 bileşenli inaktif influenza aşıları (İİA-3) ve 4 bileşenli inaktif influenza aşıları (İİA-4) mevcuttur. Ülkemizde onaylı influenza aşıları, henüz ulusal aşı çizelgemizde yer almamaktadır. İnfluenza bağışıklamasına ilişkin öneriler, İİA-3 ve İİA-4 için, çocuklarda ≥6 ay onayı dikkate alınarak uygulanmalıdır.
Mevsimsel influenza (grip) aşısı her yıl uygulanır. Grip aşısı salgın yapma olasılığı yüksek olarak öngörülen virüs tiplerine göre her yıl yeniden hazırlandığından, korunmanın sürdürülmesi isteniyorsa her yıl yinelenmelidir. Aşılama eylül-nisan ayları arasında uygulanabilir.
- Üç bileşenli inaktif influenza aşılarının (İİA-3) 6 ay – 3 yaştaki çocuklara çocuk tipi (0,25 ml), 3 yaşından büyük çocuk ve erişkinlere erişkin tipi (0,5 ml) olarak yapılması önerilir. Ülkemizde çocuk tipi İİA-3 olmadığından, İİA-3 ile aşılama 6-36 ayda yarım erişkin aşısı (0,25 ml), 3 yaş ve üstünde tam erişkin aşısı (0,5 ml) kullanılarak yapılır. Ancak aşının özellikle ilk kez uygulanacak ve 2 doz verilecek çocuklarda influenza virüs enfeksiyonu mevsimi başlamadan ya da başlangıcında (eylül-ekim ayları) uygulanması yeğlenmelidir.
- Dört bileşenli inaktif influenza aşıları (İİA-4) miktarca tek tiptir (0,5 ml); 6 aylıktan büyük bütün çocuk ve erişkinlere, İİA-4 ile olan her aşılamada miktar azaltılmaksızın uygulama önerilir.
İnsan (human) papillomavirüs (HPV) aşıları (HPA)
Başta rahimağzı (serviks) kanseri olmak üzere, vajen, vulva, anüs, penis kanserleri ve cinsel organ siğili oluşumunda büyük bir nedensel yer tutan insan papilloma virüsüne karşı geliştirilen HPV aşılarının, özellikle rahimağzı kanseri ve siğillere karşı koruyucu etkisi olduğu birçok çalışmada gösterilmiştir. Çalışmalar HPV aşılarının yüksek etkinlik ve güvenirliğini göstermektedir. HPA, ergenlik döneminde uygulandığında, ileri yaşlardaki uygulamaya göre daha etkin koruyuculuk sağlar. HPV aşısı (HPA) ölü (inaktif) aşıdır, kas içine uygulanır.
Farklı 2 üretici tarafından geliştirilen ve birçok ülkenin ulusal bağışıklama çizelgesinde uygulanan 2 HPV aşısı vardır. Ülkemizde de onaylı olan bu aşılar henüz ulusal çizelgemizde yer almamaktadır:
- Cervarix™ – 2 bileşenli HPV (HPA2) aşısı (Cervarix™): Rahimağzı kanserlerinin %70’inden sorumlu 2 HPV tipine (16, 18) karşı bağışıklık sağlar.
- Gardasil™ ve Gardasil 9™ – 4 bileşenli HPV (HPA4) aşısı (Gardasil™): Rahimağzı kanserlerinin %70’inden (16, 18) ve genital siğillerin %90’ından sorumlu (6, 11) 4 HPV tipine karşı bağışıklık sağlar.
- 9 bileşenli HPV (HPA9) aşısı (Gardasil 9™): HPA4 aşısına, rahimağzı kanseri oluşumunda toplam %20 olasılıkla yer alan başka 5 HPV tipine (31, 33, 45, 52, 58) karşı geliştirilen yeni bileşen aşıların katılımıyla oluşturulan 9 bileşenli (6, 11, 16, 18, 31, 33, 45, 52, 58) bir HPV (HPA9) aşısı olan (Gardasil 9™), Aralık 2014’ten bugüne 9-26 yaştaki kızlar, kadınlar ve erkeklerde uygulanmaktadır. Gardasil 9™ ülkemizde de onaylıdır, ancak henüz uygulamaya sunulmamıştır.
Ülkemizde en erken 9. yaşın bitiminden sonra yapılmak üzere, HPA2 üst yaş sınırı olmaksızın, HPA4, 9-26 yaş için onaylıdır. HPA4 ve HPA9 aşıları da daha büyük yaşlarda uygulanabilir; örneğin ABD’de 27-45 yaşlar arasında yapılabilecek uygulamanın aynı aşılama çizelgesiyle olması önerilir. HPA4 ve HPA9 erkek çocuk ve yetişkinler için de onaylıdır, birçok ülkenin ulusal aşılama çizelgesinde
- HPV aşılarının (HPA2, HPA4, HPA9), 9-14 yaşta “0 ve 6 ay” çizelgesiyle toplam 2 kez, ≥15 yaş için, “0, 1-2, 6 ay çizelgesi” ile 3 kez uygulanması önerilir.
Ülkemizde de HPV aşılarının 9-14 yaşta, “0 ve 6 ay” çizelgesiyle 2 kez uygulanması onaylıdır. İki aşı arasındaki süre 5 aydan kısa olmamalıdır, aralığın 5 aydan kısa olması durumunda 2. aşı yeniden yapılmalıdır.
 Konjuge, 4 bileşenli (ACWY) menengokok aşıları (KMA4)
Konjuge, 4 bileşenli (ACWY) menengokok aşıları (KMA4)
En sık hastalık nedeni olan menengokok serogruplarından dördünün (A, C, W, Y) saflaştırılmış kapsül polisakkaritlerini kapsar. Çeşitli ülkelerde uygulanmakta olan tek bileşenli (A serogrubu), iki bileşenli (A+C serogrupları) ya da başka kapsamdaki KMA’lar ülkemizde onaylı değildir
Farklı üreticilerce geliştirilen, 3 tane, 4 bileşenli; A, C, W, Y serogrup kapsül polisakkaritleri farklı taşıyıcı proteinlere bağlı (konjuge) menengokok aşısı (KMA4) ülkemizde de onaylıdır:
KMA4-CRM (Menveo™): Taşıyıcı protein olarak zehirsiz (a-toksik) CRM-197 mutant difteri toksini kullanılmıştır. KMA4-CRM ülkemizde 2. aydan sonra uygulanmak üzere onaylıdır: 2-6 aylık çocuklarda en az 2 ay arayla 3 kez, 1 yaş bittikten sonra 4. kez; 6 ay – 2 yaş dilimindeki çocuklarda, ikincisi ilkinden en az 2 ay sonra ve 1 yaş bittikten sonra uygulanmak koşuluyla 2 kez; 2 yaşından büyük çocuklar ve erişkinlerde 1 kez yapılması önerilir. KMA4-CRM’nin kullanımı, ülkemizde de 55 yaşına kadar onaylıdır. KMA4-CRM’nin 56-65 yaşındaki bireylerde kullanımına ilişkin veriler sınırlıdır, 65 yaşından büyüklerde kullanımına ilişkin veri yoktur.
KMA4-D (Menactra™): Taşıyıcı protein olarak difteri toksoidi kullanılmıştır. Ülkemizde 9. ay – 11 yaş arasındaki çocuklarda (9-23 ay arasında 3 ay arayla 2 doz, 2 yaşından sonra 1 doz) uygulanmak üzere onaylıdır.
KMA4-T (Nimenrix™): Taşıyıcı protein olarak tetanoz toksoidi kullanılmıştır. Ülkemizde 6. haftadan sonra uygulanmak üzere onaylıdır. KMA4-T 2-6 aylık çocuklarda en az 2 ay arayla 2 kez, 1 yaş bittikten sonra 3. kez; 6 ay-1 yaş dilimindeki çocuklarda, ikincisi ilkinden en az 2 ay sonra ve 1 yaş bittikten sonra uygulanmak koşuluyla 2 kez; 1 yaşından büyük çocuklar, ergen ve erişkinlerde 1 kez yapılması önerilir. Veriler sınırlı olmakla birlikte 103 yaşında sorunsuzca uygulandığına ilişkin bilgi vardır.
KMA4 aşıları, birçok ülkenin sağlıklı çocuklara uygulanan ulusal bağışıklama çizelgesinde yer almaktadır. Sağlıklı çocuklarda, Birleşik Krallık KMA4 aşılamasında, sağlıklı çocuklara 14. yaşta 1 kez KMA4-CRM ya da KMA4-T uygulanmaktadır, ABD KMA4 uygulamasındaysa, sağlıklı çocuklara 11-12 yaş ve 16 yaşta toplam 2 kez KMA4-CRM ya da KMA4-D uygulanması, öncesinde aşı yapılmamış olanların 13-18 yaşta aşılanması, 1. aşı 13-15 yaşta yapılırsa, 2. aşının 16-18 yaşta uygulanması (1 ve 2. aşı arasında en az 8 hafta olması), 1. aşı ≥16 yaşta yapılırsa, 2. aşının (anımsatma) uygulanmaması, 11-18 yaştaki HİV enfeksiyonlu çocukların en az 8 hafta arayla 2 kez aşılanması önerilir. KMA4 aşıları Arjantin, Avustralya, Suudi Arabistan gibi kimi ülkelerde süt çocukluğu dönemi ulusal aşılama çizelgelerinde uygulanmaktadır.
Yayılgan (invazif) menengokok hastalığı açısından yüksek risk oluşturan başlıca durumlar, yapısal ya da işlevsel dalak yokluğu, orak hücre hastalığı, kompleman (C5-9, properdin, faktör D, faktör H) eksiklikleri, HİV enfeksiyonu, kompleman engelleyicisi (örneğin ekulizumab, ravulizumab) kullanımı, yüksek endemik bölgeye yolculuk, riskin, ilişkinin yüksek olduğu epidemi gibi durumlar olarak özetlenebilir.
Menengokok B serotipi aşısı iki üreticinin çeşitli ülkelerde uygulanmakta olan 2 ayrı menengokok B serotipi aşısı vardır (Bexsero™, Trumenba™).
Bugün için bu aşılardan yalnızca biri (4CMenB aşısı, Bexsero™) ülkemizde de 2. aydan sonra uygulanmak üzere onaylıdır.4CMenB aşısı, menengokok yüzeyinde sergilenen korunmuş proteinler belirlenip, kökene özgül olmayan antijenleri (bir dış zar vezikülü ve içerdiği porin A, faktör H bağlayan protein, rekombinan Neisseria adezini A, Neisseria heparin bağlayan antijeni) kapsayan bir aşı olarak “ters vaksinoloji” yöntemiyle geliştirilmiştir. 4CMenB aşısının, 2-6 aylık çocuklarda 2 ay (en az 1 ay) arayla 3 kez, 1 yaş bittikten sonra 4. kez; 6-11 aylık çocuklarda en az 2 ay arayla 2 kez, ikinci aşıdan en az 2 ay sonra olmak üzere, yaşamın ikinci yılında 3. kez; 12-23 ay yaş dilimindeki çocuklarda en az 2 ay arayla 3 kez; 2-10 yaş dilimindeki çocuklarda en az 2 ay arayla 2 kez; 10 yaşından büyük çocuklar ve erişkinlerde en az 1 ay arayla 2 kez yapılması önerilir. Öte yandan, kimi ülkelerde, örneğin Birleşik Krallık uygulamasında Bexsero™ ile menengokok B aşılaması, 2-6 ay yaş diliminde başlandığında, en az 2 ay arayla 2 kez, 1 yaş bittikten sonra 3. kez olmak üzere toplam 3 kez yapılmaktadır. Epidemik ya da endemik olabilen yayılgan (invazif) menengokok enfeksiyonları, ülkemizde genellikle endemiktir. Menengokok hastalığı görülme sıklığı genelde 3 farklı yaş diliminde yoğunlaşma eğilimi gösterir; 5 yaşından küçük bebek ve çocuklar (özellikle 65 yaşta olanlar.
Yayılgan menengokok enfeksiyonu görülme sıklığı, ülke ve bölgelere göre ve aynı ülkede bile yıldan yıla değişebilir, serogrup dağılımlarında da büyük farklılıklar olabilir. Bu nedenle, ülkeler ulusal bağışıklama çizelgelerine kendilerine uygun serotipleri içeren farklı aşıları alabilir. Ülkemizdeki çalışmalarda menengokok taşıyıcılık oranı %1-21 arasında bildirilmiş olup, yıllık yayılgan menengokok hastalığı görülme sıklığı, DSÖ’nün orta ya da düşük-orta endemik bölge ölçütlerine uyacak biçimdedir.
Dr. Oğuz Derya Kaplan
Kaynaklar
- Public Health England. Routine childhood immunisations from January 2020. Available from: https://assets.publishing.service.gov.uk/ government/uploads/system/uploads/attachment_data/file/849165/ PHE_childhood_immunisation_schedule_Jan2020.pdf (Erişim tarihi: 23.06.2020)
- Centers for Disease Control and Prevention (CDC). Recommended Child and Adolescent Immunization Schedule for ages 18 years or younger, United States, 2020. Available from: https://www.cdc.gov/vaccines/ schedules/downloads/child/0-18yrs-child-combined-schedule.pdf (Erişim tarihi: 23.06.2020).
- Arısoy ES, Çiftçi E, Hacımustafaoğlu M, Kara A, Kuyucu N, Somer A ve ark. Önceden Sağlıklı Çocuklarda Türkiye Ulusal Bağışıklama Çizelgesinde (Ulusal Aşı Takvimi) Yer Alan ve Almayan Aşılara İlişkin Uygulama Önerileri – 2020. J Pediatr Inf 2020; ;14(3):180-193
- World Health Organization [Internet]. Geneva: Immunization, Vaccines and Biologicals. Global immunization coverage sustained in the past five years, 2016
